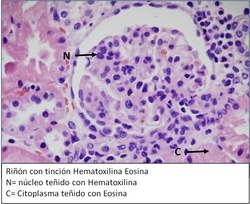
Para la mención de Morfofisiopatología y Citodiagnóstico es necesario saber que procedimientos realizar ante una sospecha diagnóstica, donde la última palabra se da por medio de los resultados otorgados en el Laboratorio de Anatomía Patológica.
Uno de los procedimientos más importantes dentro del Laboratorio son las tinciones, ya que con ellas se puede diferenciar distintas estructuras del tejido, pudiendo observar donde se encuentra la presunta lesión.
Las tinciones se dividen según la zona del tejido que van a teñir, las cuales son:
- Tejido conectivo
- Membrana Basal
- Citoplasma
- Nuclear
Cada colorante, tiene un fundamento teórico molecular, donde básicamente se unen a componentes estructurales de la célula, como glicolípidos, proteínas, cromatina, matriz celular, etc.
La tinción de rutina en el Servicio se compone de 2 colorantes:
Hematoxilina: tinción nuclear, se une a los componentes ácidos de la célula. Es de carácter básico, es soluble en agua y en alcohol, pero por sí sola no colorea, necesitando entonces de un oxidante y de un mordiente (sustancia que sirve para fijar el colorante)
Moléculas ácidas de la célula
- Núcleo celular: rico en ácido desoxirribonucleico (ADN)
- Ribosomas: Rico en ácido ribonucleico (ARN)
- Retículo endoplasmático Rugoso: rico en ribosomas
Eosina: tinción citoplasmática, se une a los componentes básicos de la célula. Es de carácter ácido.
Moléculas básicas de la célula - Mitocondrias: cargadas de enzimas (proteínas)
- Proteínas intracelulares
- Proteínas extracelulares: colágeno del tejido conectivo
Uno de los procedimientos más importantes dentro del Laboratorio son las tinciones, ya que con ellas se puede diferenciar distintas estructuras del tejido, pudiendo observar donde se encuentra la presunta lesión.
Las tinciones se dividen según la zona del tejido que van a teñir, las cuales son:
- Tejido conectivo
- Membrana Basal
- Citoplasma
- Nuclear
Cada colorante, tiene un fundamento teórico molecular, donde básicamente se unen a componentes estructurales de la célula, como glicolípidos, proteínas, cromatina, matriz celular, etc.
La tinción de rutina en el Servicio se compone de 2 colorantes:
Hematoxilina: tinción nuclear, se une a los componentes ácidos de la célula. Es de carácter básico, es soluble en agua y en alcohol, pero por sí sola no colorea, necesitando entonces de un oxidante y de un mordiente (sustancia que sirve para fijar el colorante)
Moléculas ácidas de la célula
- Núcleo celular: rico en ácido desoxirribonucleico (ADN)
- Ribosomas: Rico en ácido ribonucleico (ARN)
- Retículo endoplasmático Rugoso: rico en ribosomas
Eosina: tinción citoplasmática, se une a los componentes básicos de la célula. Es de carácter ácido.
Moléculas básicas de la célula - Mitocondrias: cargadas de enzimas (proteínas)
- Proteínas intracelulares
- Proteínas extracelulares: colágeno del tejido conectivo
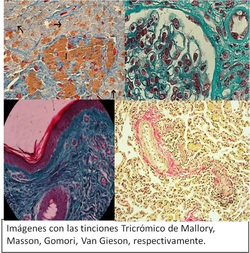
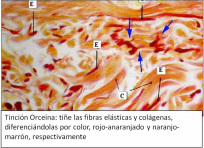
También existen las tinciones que se componen de 2 o más colorantes que permiten visualizar las fibras de colágeno pertenecientes al tejido conectivo, que se comportan como haces de fibras que otorgan soporte al tejido. Estas tinciones son las llamadas Tricrómicas, ya que por medio de más colorantes logran una diferenciación de estructuras.
Algunas de ellas son:
- Tricrómico de Mallory
- Tricrómico de Masson (azul o verde luz)
- Tricrómico de Gomori
- Van Gieson
- Orceína
Se considera la coloración de Van Gieson la más selectiva de las fibras colágenas; sin embargo la de Gomori y Masson son consideradas confiables por la reproducibilidad de sus resultados y la simplicidad operativo.
Algunas de ellas son:
- Tricrómico de Mallory
- Tricrómico de Masson (azul o verde luz)
- Tricrómico de Gomori
- Van Gieson
- Orceína
Se considera la coloración de Van Gieson la más selectiva de las fibras colágenas; sin embargo la de Gomori y Masson son consideradas confiables por la reproducibilidad de sus resultados y la simplicidad operativo.
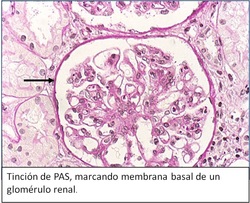
PAS: Técnica de Ácido Peryódico de Schiff, los grupos aldehídos son expuestos por el reactivo de Schiff, los cuales se unen a la fucsina, que se agrega minutos después.
Los componentes celulares que serán positivos en la coloración, son:
- Polisacáridos simples
- Mucopolisacáridos neutros
- Mucoproteínas
- Glucoproteínas del suero, membrana basal y fibras de reticulina
- Glucolípidos
- Pigmentos ceroide y ciertas lipofucsinas
Para darle un contraste y no ver todo el tejido de color fucsia, se utiliza hematoxilina (como preferente), tiñendo los núcleos.
Los componentes celulares que serán positivos en la coloración, son:
- Polisacáridos simples
- Mucopolisacáridos neutros
- Mucoproteínas
- Glucoproteínas del suero, membrana basal y fibras de reticulina
- Glucolípidos
- Pigmentos ceroide y ciertas lipofucsinas
Para darle un contraste y no ver todo el tejido de color fucsia, se utiliza hematoxilina (como preferente), tiñendo los núcleos.
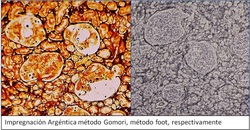
Otras técnicas que se utilizan en el Laboratorio de Anatomía Patológica, son las Impregnaciones argénticas, que no son un coloración propiamente tal, sino que por medio de precipitación de plata, se marcan las fibras reticulares de los tejidos, o también utilizadas para el tejido nervioso.
La forma de precipitación depende principalmente de su naturaleza, que puede ser argirófilo o argentafin, que se diferencian por necesitar o no un proceso de reducción para que la plata precipite.
En el servicio se utilizan 2 técnicas para fibras reticulares (las más comunes) y un para tejido nervioso.
Fibras Reticulares
- Método Gomori: posee una diferenciación con Cloruro de Oro
- Método Foot: no posee diferenciación
La forma de precipitación depende principalmente de su naturaleza, que puede ser argirófilo o argentafin, que se diferencian por necesitar o no un proceso de reducción para que la plata precipite.
En el servicio se utilizan 2 técnicas para fibras reticulares (las más comunes) y un para tejido nervioso.
Fibras Reticulares
- Método Gomori: posee una diferenciación con Cloruro de Oro
- Método Foot: no posee diferenciación
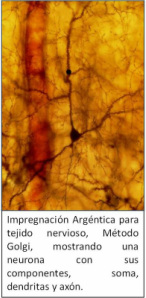
Tejido Nervioso
Método de Golgi: es posible observar las células nerviosas aisladas o en grupos (poblaciones), apreciándose no tan solo el soma, sino también sus procesos. Detectándose en estas células casi todo el territorio del árbol dendrítico.
Método de Golgi: es posible observar las células nerviosas aisladas o en grupos (poblaciones), apreciándose no tan solo el soma, sino también sus procesos. Detectándose en estas células casi todo el territorio del árbol dendrítico.
Escrito por: Constanza Baeza B.
Bibliografía
- Sheehan, Dezna; Hrapchak, Barbara. Theory and practice of Histotechnology (2 Ed. edición). The C.V. Mosby Company.
- ARP, ed. Métodos Histotecnológicos. Instituto de patología de las Fuerzas Armadas de los EEUU (AFIP).
- P. Prentø “Staining of macromolecules: possible mechanisms and examples” School of Medical Laboratory Science, Metropolitan University College, university Copenhagen, Copenhagen, Denmark, Febreo 19, 2009
- [Sin autor determinado] “Curso básico de técnicas histológicas” Universidad de Los Andes, Facultad de Medicina, Departamento de ciencias morfológicas, Unidad Académica de Histología
Bibliografía
- Sheehan, Dezna; Hrapchak, Barbara. Theory and practice of Histotechnology (2 Ed. edición). The C.V. Mosby Company.
- ARP, ed. Métodos Histotecnológicos. Instituto de patología de las Fuerzas Armadas de los EEUU (AFIP).
- P. Prentø “Staining of macromolecules: possible mechanisms and examples” School of Medical Laboratory Science, Metropolitan University College, university Copenhagen, Copenhagen, Denmark, Febreo 19, 2009
- [Sin autor determinado] “Curso básico de técnicas histológicas” Universidad de Los Andes, Facultad de Medicina, Departamento de ciencias morfológicas, Unidad Académica de Histología
 RSS Feed
RSS Feed